L’apparato respiratorio: anatomia, fisiologia ed ontogenesi
Lucia Camisassa
Visite: 25500
Mi sembra indispensabile, visto il tema del mio lavoro, dare degli accenni di anatomo-fisiologia polmonare dell’essere umano. In questo nuovo capitolo andrò ad esporre:
- brevi cenni di fisiologia della respirazione;
- sviluppo del sistema respiratorio nel feto e nel neonato e brevi cenni che spiegano le caratteristiche della circolazione sanguigna fetale, che diventando circolazione neonatale possono portare a problematiche e ricadute anche sul sistema respiratoro;
- differenze anatomo-funzionali del sistema respiratorio che sussistono tra il neonato pretermine, il neonato a termine e l’individuo adulto.
Rapporti struttura - funzione: cenni di anatomia funzionale
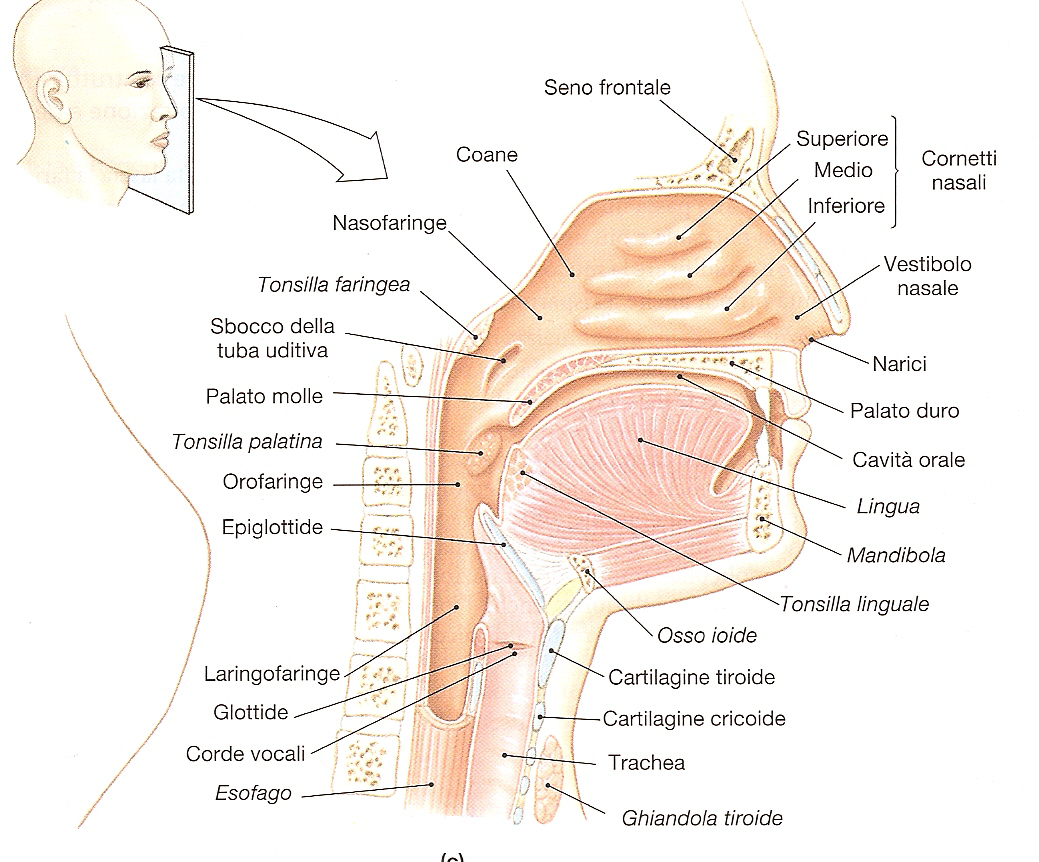
Figura 3. Naso, cavità nasale sinistra e faringe in sezione sagittale dopo rimozione del setto nasale.
L’apparato respiratorio è costituito da una serie di strutture che comprendono:
- La gabbia toracica;
- La muscolatura respiratoria e quindi: il diaframma, la muscolatura inspiratoria e la muscolatura espiratoria;
- I visceri respiratori suddivisi in: le vie aeree superiori, le vie aeree inferiori, il parenchima polmonare, i vasi polmonari e bronchiali, i vasi linfatici.
- Le strutture nervose centrali e periferiche che regolano la ventilazione e la perfusione in relazione alle diverse esigenze dell’organismo, anch’essi concorrono alla funzione respiratoria.
La ventilazione è sotto controllo dei centri nervosi, detti centri respiratori, localizzati nel SNC, che regolano la profondità e la ritmicità del respiro in condizioni normali di riposo. Esistono poi strutture recettoriali periferiche e centrali, deputate ad inviare segnali di natura fisica, chimica e sensoriale al SNC, che consentono di adattare i diversi parametri del ciclo respiratorio alle varie situazioni fisiologiche o patologiche.

Figura 4. Centri respiratori e riflessi di controllo. Sono indicate le sedi dei principali centri di controllo respira- torio nonché altri fattori importanti per il controllo riflesso della respirazione.
Le strutture nervose:
- Strutture nervose centrali: la struttura principale deputata al controllo del ritmo respiratorio spontaneo è il centro respiratorio bulbare (sotto il pavimento del IV ventricolo). Cranialmente a questo sono disposti altri 2 raggruppamenti neuronali (centro pneumotassico e centro apneustico) che regolano l’attività del centro bulbare sulla base delle informazioni fornite dalle strutture recettoriali periferiche. Infine in sede midollare sono situati i nuclei dei muscoli respiratori.
- Strutture nervose periferiche: il sistema nervoso autonomo di controllo dell’apparato respiratorio è costituito da un sistema eccitatorio parasimpatico o colinergico, un sistema inibitorio simpatico o adrenergico e un sistema non adrenergico e non colinergico che può esercitare azioni diverse, secondo il tipo di mediatore rilasciato.
I visceri respiratori
Le vie aeree superiori:
sono costituite dalle coane nasali, dalla faringe, dal cavo orale e dalla laringe.
Gli orifizi delle coane nasali e il cavo orale rappresentano le vie attraverso le quali l’aria raggiunge l’apparato respiratorio. Le coane nasali, divise dal setto mediano, sono in parte occupate dai turbinati (strutture convolute), che riscaldano ed umidificano l’aria inspirata. L’effetto di filtro meccanico blocca le particelle di diametro superiore a 2,4μ.
La faringe non possiede uno scheletro osteocartilagineo e il sostegno delle sue pareti è assicurato dal tono dei muscoli parietali. È rivestita da un epitelio squamoso ed è caratterizzata dalla presenza di tonsille e adenoidi (aggregati di linfonodi deputati alla regolazione delle risposte immunitarie). In condizioni normali la faringe rappresenta una via di passaggio relativamente ampia, che non offre particolare resistenza all’aria inspirata.
La laringe è una struttura muscolo-cartilaginea, ricoperta da epitelio squamoso e in alcune zone da epitelio cilindrico ciliato. È caratterizzata dalla presenza di 2 strutture: l’epiglottide e le corde vocali. L’epiglottide è una cartilagine ancorata alla base della lingua che durante la deglutizione evita che il cibo passi in laringe. Le corde vocali, 2 pieghe mucose poste sotto l’epiglottide, vengono abdotte durante la respirazione; l’adduzione parziale è alla base dell’attività fonatoria, mentre la loro adduzione totale determina la chiusura della glottide, indispensabile per creare gli incrementi di pressione intratoracica e intra-addominale per creare gli incrementi di pressione intratoracica e intra-addominale necessari durante la tosse e i conati di vomito.
Vie aeree inferiori:
Sono costituite dalla trachea, dai bronchi con le loro diramazioni e dai polmoni.
La trachea è costituita da un condotto cilindrico che si estende dalla laringe sino all'altezza della IV - V vertebra toracica, dove si biforca nei 2 bronchi principali (il destro è abitualmente più corto del sinistro). La mucosa tracheale è rivestita da epitelio cilindrico ciliato pseudostratificato (che ha la funzione di far progredire il muco verso la glottide, svolge un compito protettivo di barriera e partecipa ai processi riparativi e cicatriziali) e contiene numerose ghiandole mucose secernenti. Dai bronchi principali si dipartono a destra il bronco lobare superiore e quello intermedio (dal quale originano il medio e l'inferiore). A sinistra invece si dipartono il lobare superiore e il lobare inferiore. Per ramificazione di ciascuno dei bronchi lobari si generano i bronchi segmentari (10 a destra e 9 a sinistra). I bronchi segmentari si suddividono a loro volta in rami subsegmentari e questi danno origine, successivamente ad ulteriori ramificazioni, a vie aeree di calibro sempre minore fino a giungere alle strutture alveolari.
I diversi ordini di vie aeree nei quali si ramifica l'albero bronchiale possono essere classificati secondo la struttura delle loro pareti.
S'identificano come bronchi quelle vie aeree la cui parete contiene cartilagine, che scompare nei bronchioli (sia i bronchioli terminali sulle cui pareti non si affacciano gli alveoli che i bronchioli respiratori nei quali sono riconoscibili strutture alveolari). Il diametro dei bronchi e dei bronchioli diminuisce progredendo in direzione distale, ma la somma dell'area delle sezioni traverse delle vie aeree di pari generazione ha dimensioni sempre maggiori man mano che si progredisce verso le vie aeree di diametro inferiore. I bronchi di diametro superiore ai 3-5 mm (circa 10, 12 ordini di divisioni) hanno struttura quasi rigida e quindi non possono variare il loro calibro. I bronchioli invece possono variare il loro calibro a seconda che la muscolatura si contragga o si rilasci, in virtù della progressiva riduzione della componente cartilaginea. I muscoli lisci bronchiali costituiscono la componente muscolare che è la struttura fondamentale della parete delle vie aeree (sono presenti a tutti i livelli e aumentano percentualmente man mano che diminuisce la componente cartilaginea).
Ciascun bronchiolo respiratorio dà luogo ad un numero variabile di dotti alveolari (condotto a forma di tronco di cono a fondo cieco nei sacchi polmonari). Sulla parete dei dotti alveolari si aprono gli alveoli e il complesso delle strutture tributarie del bronchiolo terminale prende il nome di acino polmonare. Un carattere anatomico degli acini è rappresentato dalla presenza di strutture deputate ad assicurare la ventilazione collaterale, qualora il sistema bronchiale fosse ostruito.
La circolazione broncopolmonare
È caratterizzata dalla presenza di un duplice sistema circolatorio, il circolo polmonare e quello bronchiale.
Le funzioni del sistema arterioso polmonare sono quelle di consentire gli scambi gassosi e di nutrire il parenchima polmonare. L'arteria polmonare nasce dal ventricolo destro e si ramifica in maniera dicotomica asimmetrica, seguendo il decorso delle vie aeree, fino a generare una fitta rete anastomotica capillare a livello degli alveoli.
La funzione principale del sistema arterioso bronchiale è invece la nutrizione dell'albero bronchiale sino a livello dei bronchi terminali, mentre l'irrorazione delle diramazioni bronchiali di più piccolo calibro è di pertinenza del circolo polmonare. Le arterie bronchiali sono afferenti alla circolazione sistemica.
L'interstizio
Ogni bronco e bronchiolo è accompagnato nelle sue suddivisioni dai rami sempre più fini delle arterie, delle vene polmonari e dei vasi linfatici.
L’insieme di tutte queste strutture, sostenute da connettivo e tessuto elastico costituiscono l’interstizio polmonare.
Va immaginato come una rete che andando verso la periferia, diventa più fine, fino ad avvolgere gli alveoli. L'interstizio è ricco di fibre elastiche che permettono al polmone, se lo si lascia libero, di svuotarsi spontaneamente. La perdita di queste fibre elastiche, rende il polmone più facilmente espansibile, ma ne riduce la capacità di svuotarsi.
Le pleure: le pleure sono membrane molto sottili, che fasciano il polmone e rivestono la parete toracica interna (pleura viscerale, pleura parietale). Vanno intese come un'unica struttura, senza interruzione. Tra le due pleure vi è pochissimo liquido che serve a lubrificare lo scorrimento dei due foglietti pleurici durante il movimento del polmone. Nella normalità lo spazio tra i due foglietti pleurici è virtuale, ed ha al suo interno una pressione negativa necessaria a tenere espanso il polmone.
A differenza del polmone, privo di nervi sensitivi, le pleure sono ben innervate, quindi se si infiammano o subiscono un danno, provocano dolore.


Figura 5. I muscoli respiratori. (a) Movimenti delle coste e del diaframma che aumentano il volume della gabbia toracica. (b) Gabbia toracica e diaframma in posizione di riposo. Veduta laterale durante l’inspirazione (c), che mostra i muscoli coinvolti nell’elevazione delle coste e durante l’espirazione, che mostra i muscoli coinvolti nell’abbassamento delle coste.
7 2.1.3 La parete toracoaddominale
I polmoni sono contenuti all'interno della gabbia toracica (struttura osteocartilaginea, di forma grossolanamente troncoconica) E’ composta da strutture ossee (coste, vertebre esterno) e dai muscoli respiratori che si suddividono in muscoli inspiratori (muscoli diaframmatici, muscoli intercostali esterni, la porzione cartilaginea dei muscoli intercostali interni, muscoli sternocleidomastoidei e scaleni) ed in muscoli espiratori (muscoli intercostali interni interossei, muscoli della parete addominale).
Questi muscoli striati, che posseggono caratteristiche strutturali indistinguibili da qualunque altro muscolo scheletrico, hanno però la peculiarità di essere posti sotto un controllo sia volontario che involontario. Nella respirazione normale a riposo, l'inspirazione è sempre un processo attivo, in cui il diaframma e gli altri muscoli inspiratori espandono la gabbia toracica e quindi i polmoni, mentre l'espirazione è normalmente un processo passivo, dovuto all' elasticità dei polmoni che tendono a svuotarsi spontaneamente (Figura 5).
Meccanismi di difesa dell'apparato respiratorio
La mucosa del tratto respiratorio è la mucosa di confine più estesa del corpo umano. Anche se esposta ogni giorno a microrganismi, tossine, polveri e altre sostanze estranee all'organismo, essa riesce a difendersi. Nella sottomucosa delle vie aeree risiede la porzione basale delle ghiandole bronchiali e una ricca popolazione dei linfociti B, plasmacellule e mastocellule, nonché le terminazioni nervose, afferenti ed efferenti dell'innervazione adrenergica e colinergica. La membrana basale è relativamente permeabile, così da permettere l'accesso ai canali intercellulari tra le cellule epiteliali. Lo strato di cellule più periferico è ciliato, e l'estremità luminare di queste cellule è circondata da "tight junctions", che uniscono strettamente le cellule tra loro. Tra le cellule ciliate si trovano sparse numerose "globlet cells" (cellule mucose) e cellule sierose con microvilli che hanno funzioni assorbenti. A livello delle biforcazioni tracheali, dove il flusso da laminare tende a diventare turbolento, si trovano aree di epitelio senza cellule ciliate, ma composto di cellule linfoepiteliali.
L'epitelio colonnare pseudostratificato e ciliato delle vie aeree giunge fino ai bronchioli terminali, oltre ai quali diventa cuboidale. La particolarità di questo epitelio risiede nella capacità di regolare l'afflusso da H20 e soluti dall'ambiente interno verso il lume bronchiale, funzione essenziale nel garantire una buona efficienza dei meccanismi di difesa polmonare. L'effetto barriera è svolto dall' epitelio e da una unità funzionali che comprende anche il cosiddetto "epithelial lining fluid" sul versante luminare e, verso l'interno, dalla matrice proteica che forma la membrana basale epiteliale. Le molecole più grandi, come le proteine, giungono nel lume per la via transcellulare, mentre i soluti più piccoli giungono al lume per via sia transcellulare sia paracellulare. La via e la velocità di conduzione sono strettamente regolate dalle cellule epiteliali respiratorie, che secernono, con meccanismo di trasporto attivo, le proteine e gli altri soluti che passano attraverso la cellula.
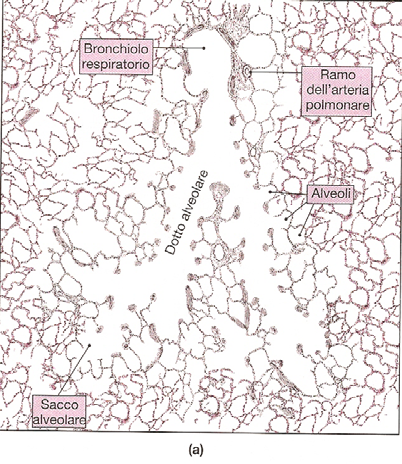

Figura 6. I bronchioli. Bronchiolo respiratorio che rifornisce una parte di lobulo polmonare (a). sacchi alveolari e alveoli (b).
Sistema di trasporto mucociliare
La comparsa dell'epitelio ciliato avviene nel feto già verso il II, III mese di gestazione, partendo dalle alte vie aeree e poi propagandosi distalmente. Alla nascita le cellule ciliate sono presenti fino ai bronchioli terminali. Ogni cellula ciliata ha un aspetto colonnare e presenta verso il suo polo luminare 100 - 200 cilia lunghe circa 6 μm, con un diametro di 0,3 μm. il movimento ciliare ha una frequenza variabile tra i 12 e i 15 battiti/sec (Hz). Le cellule espiratorie ciliate posseggono recettori adrenergici e colinergici, per cui rispondono allo stimolo farmacologico con queste sostanze. Nella pratica clinica, gli usuali agonisti per i β-adrenorecettori vengono usati per il loro effetto di broncodilatatori, ma una loro azione non secondaria è anche quella di aumentare il battito ciliare e quindi, il trasporto mucociliare. Le cilia, grazie alla peculiarità del loro battito, riescono a far progredire il film mucoso sovraepiteliare verso il cavo orofaringeo, spostandolo dalle zone più profonde fino alla trachea e faringe. A livello della faringe, il muco che proviene continuamente dalle vie aeree, viene poi deglutito in modo impercettibile. Se la mucosa bronchiale è infiammata le ghiandole aumentano la produzione di muco, che viene quindi espulso con la tosse.
Le secrezioni bronchiali sono una mistura estremamente complessa, prodotta dai diversi tipi di cellule che aggettano nel lume bronchiale. Giocano un ruolo essenziale nell'idratare e nel proteggere l'epitelio respiratorio e nel consentire la clearance delle particelle inalate, batteriche e non. Per garantire un'efficace clearance mucociliare è essenziale che le secrezioni bronchiali abbiano ben precise caratteristiche reologiche e di adesività. Quando queste si alterano, soprattutto per l'aggiunta di prodotti derivanti dallo stato di infiammazione della mucosa, la clearance mucociliare diventa inefficace e le secrezioni si accumulano.
Cenni di fisiologia della respirazione
L’obiettivo prioritario dell’organo polmone è l’apporto di O2 ai tessuti e la rimozione della CO2 generata dai processi metabolici cellulari che sono garantiti dall’attività simultanea dell’apparato respiratorio e del sistema cardiocircolatorio.
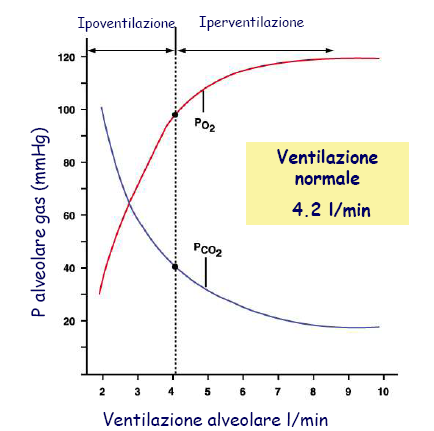
Figura 7. Ventilazione alveolare
Le fasi principali di questo processo sono:
- La ventilazione polmonare, che consiste nell’immissione ritmica di gas nell’alveolo;
- La diffusione di O2 e CO2 a livello dell’unità alveolo-capillare;
- La perfusione capillare, che consente il trasporto di O2 e CO2 verso e dai tessuti.
Fisiologia broncopolmonare
La respirazione consiste in una serie di eventi che concorrono al’utilizzazione del’O2 da parte delle cellule dell’organismo ed alla eliminazione della CO2 da esse prodotta.
Possiamo differenziare tre fasi distinte nella respirazione:
- Una fase polmonare in cui l’aria veicolata nei polmoni scambia a livello alveolare O2 e CO2 con il sangue e poi viene espirata;
- Una fase circolatoria in cui il sangue arterializzato, cioè ricco di O2, viene portato ai diversi tessuti e quindi riportato al polmone come sangue venoso;
- Una fase tissutale o cellulare in cui l’O2 viene utilizzato dalle cellule che producono CO2 come scoria metabolica.

Figura 8. Albero polmonare
La funzione principale dell’apparato respiratorio è quindi quella di portare l’aria a contatto con il sangue della circolazione polmonare, al fine di ossigenare il sangue per portare ossigeno alle cellule e di rimuovere dal sangue l’anidride carbonica che si produce nei tessuti per il metabolismo cellulare.
Insieme a questa, anche la capacità di mantenere costante l’equilibrio acido- base, mantenendo il pH del sangue entro certi limiti, per consentire il corretto funzionamento delle cellule dell’organismo, è considerata come funzione principale.
Sono invece funzioni accessorie la difesa contro i microorganismi, l’eliminazione di sostanze volatili, la sintesi di alcune sostanze biologicamente attive e la termoregolazione.
Il raggiungimento delle funzioni principali passa attraverso fasi specifiche e coordinate. Il malfunzionamento di una sola di queste fasi può determinare l’alterazione di tutto il sistema:
- La ventilazione: è lo spostamento dell’aria dall’esterno della superficie di scambio e viceversa. Alla ventilazione concorrono la gabbia toracica con tutti i muscoli respiratori e le vie aeree di conduzione.
- La diffusione: è lo scambio di gas vero e proprio tra aria e sangue. Si realizza negli alveoli polmonari, la cui superficie separa l’aria dal sangue ed è detta barriera alveolo-capillare.
- La perfusione: è la distribuzione del sangue all’interno del polmone. Il sangue è in questo modo portato in contatto con la barriera alveolo- capillare.
- Il trasporto dei gas: è l’insieme dei meccanismi con cui l’ossigeno viene portato ai tessuti e l’anidride carbonica viene portata dai tessuti al polmone. Questo trasporto è a carico dell’emoglobina (Hb) contenuta all’interno dei globuli rossi.
- I meccanismi di controllo: sono deputati alla regolazione, in base alle esigenze dell’organismo, di tutte le funzioni sopra citate. In modo particolare condizionano la ventilazione, con le modificazioni dei parametri di frequenza e profondità dell’atto respiratorio agendo sul calibro delle vie aeree, e la perfusione incidendo sulla portata sanguigna e sulla sua distribuzione.

Figura 9. Curva di dissociazione dell’emo- globina nel neonato (70% di HbF) e nell’adulto in condizioni stazionarie.
La ventilazione è un processo dinamico che porta a modificazioni quantitative dell’aria contenuta nei polmoni, espresse da volumi e da capacità polmonari.
Sviluppo del sistema respiratorio nel feto e nel neonato
La descrizione dell’ontogenesi polmonare ci permette di affrontare meglio, in qualità di riabilitatori, le problematiche respiratorie che si evidenziano nei neonati e nei prematuri presenti nelle TIN.
È quindi molto importante comprendere le diverse tappe dello sviluppo polmonare: è un percorso molto lungo che comincia intorno alle 4 settimane di età gestazionale per concludersi dopo la nascita a termine del bambino e proseguire nella maturazione oltre i 15 anni di età.


Figura 10. Struttura di un lobulo polmonare all’interno di un segmento broncopolmonare.
Il polmone umano, nato come una piccola estroflessione dell’intestino primitivo durate le prime settimane di gestazione, cresce fino a formare nell’età adulta una superficie di scambio di circa 70-100 m2; la barriera che separa l’aria dal sangue ha uno spessore di circa 0,2 micron. Da un punto di vista strutturale si riconosce, nel polmone, una zona destinata alla conduzione dei gas, che va dalla trachea ai bronchioli terminali ed è caratterizzata da una serie di 23 successive dicotomie dell’albero respiratorio e una zona alveolata dove avvengono gli scambi di gas e di cui l’acino rappresenta l’unità funzionale. L’acino (Figura 10) comprende i bronchioli respiratori, che spesso presentano alveoli sulle pareti, i dotti alveolari e gli alveoli stessi caratterizzati da una struttura esagonale. L’area di questa superficie è assai vasta e mantiene un rapporto costante con la massa corporea durante la crescita post-natale (circa 1 m2/Kg).
Gli alveoli sono tappezzati da due tipi di cellule epiteliali: le cellule di tipo I, o pneumoniti membranosi, caratterizzate da un’accentuata estensione e sottigliezza del citoplasma ricoprono il 95% della superficie alveolare, e le cellule epiteliali di tipo II, o pneumoniti granulari, caratterizzate istologicamente dalla presenza di corpi lamellari nel citoplasma e, pur essendo più numerose delle cellule di tipo I, ricoprono solo il 5% della superficie alveolare per la loro struttura cuboidale.
I pneumoniti di tipo II, che si differenziano verso la 22a settimana di età gestazionale (EG), sono le cellule deputate alla sintesi e all’immagazzinamento del surfattante sotto forma di corpi lamellari, la cui presenza nel liquido polmonare è notevolmente ritardata rispetto alla sua comparsa a livello cellulare. Hanno un ruolo di primo piano nei processi riparativi alveolari, sono in grado di trasportare attivamente ioni contro un gradiente elettrochimico, per cui sono coinvolte nella produzione del liquido presente all’interno del sistema respiratorio durante la vita fetale, o liquido polmonare, sia dopo la nascita nell’assicurare un’adeguata umidificazione della superficie alveolare e nel prevenire un eccessivo accumulo di fluidi a questo livello.
Lo sviluppo del polmone umano abbraccia un periodo che inizia con l’apparire della gemma polmonare nell’embrione per terminare nella prima infanzia dopo una crescita relativamente stabile e progressiva. La nascita, per quanto rappresenti un evento che implica drammatici cambiamenti nelle funzioni di quest’organo, non va considerata come un preciso punto di passaggio da uno stadio di sviluppo ad un altro. Ciò nondimeno la sua importanza giustifica la divisione dello sviluppo del polmone in una fase prenatale ed in una postnatale, anche per rimarcare che al termine della gestazione quest’organo non ha ancora raggiunto la sua maturità, momento ancora non identificato con precisione.
La fase di sviluppo prenatale del sistema respiratorio viene, a sua volta, convenzionalmente suddivisa in cinque periodi in base al quadro istologico; tra questi periodi manca una precisa demarcazione, ma la loro identificazione può comunque semplificare la comprensione della morfogenesi del polmone (Figura 11).

Figura 11. Le cinque fasi dello sviluppo polmonare: i vari periodi non hanno una netta demarcazione ed in parte si sovrappongono.
Ontogenesi del polmone
Organogenesi o periodo embrionale (1a - 7a settimana)
La gemma polmonare appare al 26° giorno di gestazione come un’estroflessione dell’intestino primitivo ed è formata da cellule epiteliali relativamente indifferenziate che si espandono nel circostante tessuto
connettivo embrionale o mesenchima (Figura 12 a.b.c). Ai lati di questa primitiva struttura iniziano a delinearsi le docce laringotracheali, la cui funzione è di separare in direzione craniocaudale la gemma polmonare dall’esofago. La connessione con l’intestino primitivo persiste solo a livello dell’estremità craniale, zona corrispondente alla futura ipofaringe.
La gemma polmonare inizia quindi ad allungarsi e a dividersi in modalità dicotomica fino a formare, verso la 5a settimana, cinque piccole strutture sacculari, due a sinistra e tre a destra, abbozzo dei futuri bronchi lobari e relativi lobi polmonari (Figura 12 d.e).
Le interazioni tra le cellule epiteliali di origine endotermica che formano l’albero respiratorio e il tessuto mesenchimale, di origine mesodermica, che lo ricopre sono di fondamentale importanza per la realizzazione del processo di ramificazione delle vie aeree; l’ablazione sperimentale del mesenchima, a dimostrazione del suo ruolo critico, determina l’arresto di tale processo.
Verso la fine della 6a settimana di gestazione le vie aeree principali, inclusi i bronchi segmentati e subsegmentali, sono complete (Figura 12 f,g). Le primitive strutture tracheobronchiali, caratterizzate da un epitelio respiratorio di tipo colonnare e relativamente indifferenziato, appaiono ancora prive di una struttura cartilaginea e muscolare, né sono innervate. Alla fine del periodo embrionale sono invece già formate le prime connessioni vascolari, così da formare un primitivo circolo polmonare.
Periodo pseudoghiandolare (6a-17a settimana)
Durante il periodo pseudoghiandolare le vie aeree continuano a suddividersi fino a formare i bronchioli terminali e le primitive strutture acidari; entro il termine di questo periodo, il processo di ramificazione bronchiale è quindi concluso e le vie aeree continueranno ad aumentare progressivamente di calibro in modo lineare rispetto al volume polmonare.
Le vie aeree prossimali sono ricoperte da un epitelio ancora spesso che va gradualmente assottigliandosi verso la periferia, ove le cellule assumono un aspetto cuboidale. Le prime cellule ciliate, le cellule mucipare e le cellule basali appaiono inizialmente nelle vie aeree prossimali, che sono ora circondate da cartilagine e muscolatura liscia, per poi comparire in seguito anche nelle vie aeree periferiche. Nell’epitelio respiratorio distale è possibile rilevare, tra la 12a e la 14a settimana di gestazione, la presenza delle proteine del surfattante A, B e C.
In questo periodo il sistema vascolare si sviluppa parallelamente alle vie aeree, cosicché al suo termine il modello gerarchico di queste ultime e dei vasi sanguigni pre-acinari è sovrapponibile a quello adulto; anche l’innervazione di queste strutture ha raggiunto un buon livello di maturazione.

Figura 12. Sviluppo dei bronchi e dei polmoni: (A-B-C), quattro settimane; (D-E), cinque settimane; (F), sei settimane; (G), otto settimane. Al termine del periodo embrionale le vie aeree maggiori sono completamente sviluppate. Modificata da Moore KL, et al. The developing human. Philadelphia: WB Saunders 1993; 230, 5th ed.

Figura 13. Schema che illustra a due diversi ingrandimenti la struttura del polmone nel periodo pseudo ghiandolare (a, b), canalicolare (c, d) e sacculare (e,f). Da notare il progressivo aumento di superficie dei futuri spazi aerei, la proliferazione dei capillari ed il graduale assottigliamento della membrana alveolo-capillare.
Periodo canalicolare (16a-26a settimana)
Il periodo canalicolare è caratterizzato dalla comparsa di canali vascolari (capillari), da cui prende il nome, e da un ulteriore sviluppo delle vie aeree distali ove compaiono le primitive strutture acidari, formate da un bronchiolo respiratorio, da un dotto alveolare e da alveoli rudimentali o sacculi. La maturazione della zona destinata allo scambio dei gas avviene per una progressiva trasformazione dei bronchioli terminali, definiti perciò “bronchioli terminali provvisori”, in due o più bronchioli respiratori, anch’essi provvisori, ognuno dei quali si differenzia a sua volta in un dotto alveolare con alveoli primitivi.
Lo sviluppo delle vie aeree terminali e della rete capillare determinano il progressivo assottigliamento del circostante mesenchima e la formazione della membrana alveolo-capillare. Tra la 20a e la 22a settimana di EG inizia la produzione di liquido polmonare, fenomeno che riflette l’avvenuto contatto tra epitelio alveolare e circolo capillare.
Alla fine del periodo canalicolare, in caso di parto prematuro, il polmone è già in grado di sostenere lo scambio dei gas, anche se la sua funzionalità è ancora precaria, soprattutto per l’insufficiente sintesi di surfattante. La somministrazione di glucocorticoidi alla madre, utilizzata per la prevenzione del distress respiratorio (RDS) in caso di minaccia di parto prematuro, stimola la sintesi del tensioattivo nel feto ed accelera la maturazione della membrana alveolo-capillare.
Periodo sacculare (25a-37a settimana)
Questa fase è caratterizzata da una spiccata dilatazione delle vie aeree terminali così da formare i sacculi, con un notevole incremento del volume polmonare e della superficie di scambio ed ulteriore assottigliamento della barriera alveolo-capillare. Si viene in tal modo a modificare anche la struttura del microcircolo, in quanto le reti capillari che avvolgono i sacculi si avvicinano progressivamente l’una all’altra, e alla fine di questo processo i setti interstiziali, o setti primari, si trovano a delimitare una doppia rete capillare necessaria per la successiva formazione dei setti secondari (Figura
14 a,b). Da un punto di vista istologico si ha la maturazione delle cellule di tipo II, ora con un ricco corredo di corpi lamellari e delle cellule di tipo I che appaiono ulteriormente assottigliate. Verso la fine della gestazione, circa alla 36a settimana, inizia la fase alveolare che avrà termine nella prima infanzia,
verso i 18-24 mesi di vita e che porterà alla formazione di un numero finale di alveoli di circa 200-300 milioni. La formazione degli alveoli è realizzata con la suddivisione dei sacculi in subunità in modo da aumentare notevolmente la superficie di scambio. Va rilevato che l’inizio e il termine della fase alveolare e il numero finale di alveoli sono tutt’ora motivo di controversia per l’estrema difficoltà ad eseguire e a standardizzare queste rilevazioni istologiche.

Figura 14. Modificazioni della struttura del circolo capillare polmonare durante la vita fetale e postnatale. Una rete capillare (C) tridimensionale si forma a livello del mesenchima nel periodo pseudoghiandolare e canalicolare (A). Le reti capillari che avvolgono le primitive strutture sacculari si avvicinano progressivamente l’una con l’altra per la riduzione del tessuto interstiziale, ed alla fine di questo processo i setti primari si trovano a delimitare una doppia rete capillare (B). La doppia rete capillare è un requisito essenziale per consentire la formazione dei setti secondari (frecce) nel periodo perinatale (C). La trasformazione da doppio a singolo strato della rete capillare contenuta all0interno dei setti secondari o setti alveolari e l’assottigliamento della membrana alveolo-capillare rappresentano l’ultimo stadio dello sviluppo polmonare (D)
La fase di alveolarizzazione va in ogni modo considerata un evento prevalentemente postnatale, dato che circa l’85% degli alveoli si forma entro i primi 24 mesi, anche se un progressivo, ma lieve incremento, sembra avvenire fino agli 8 anni di vita.
Alla fine della 36a settimana inizia ad essere prodotto il surfattante da parte di alcune cellule presenti negli alveoli, i pneumociti di II grado.
Il surfattante è una sostanza che riveste il versante aereo della membrana alveolo-capillare. Le sue funzioni principali sono così riassumibili:
- Riduzione del lavoro respiratorio per la maggiore attitudine del polmone ad essere disteso;
- Aumento della capacità funzionale residua per la minore tendenza del polmone al collasso;
- Ruolo antiedemigeno, in quanto l’aumento della tensione superficiale facilita il richiamo di liquidi nei capillari dell’alveolo;
- Stabilizzazione delle dimensioni alveolari.
Secondo recenti studi, il surfattante avrebbe anche una funzione di difesa di fronte agli agenti infettivi, riducendo l’adesività dei batteri e facilitandone la fagocitosi da parte dei macrofagi. Il surfattante rivestirebbe, inoltre, un importante ruolo di facilitazione della clearance muscolare, diminuendo l’adesività del muco sull’epitelio.
Sviluppo postnatale del polmone: periodo alveolare e maturazione del circolo polmonare (36a-18 mesi postnatali).
Lungo le pareti intersacculari o setti primari si formano delle creste, o setti secondari, che appaiono al microscopio elettronico come piccole estroflessioni superficiali dell’epitelio. Analizzati in sezione, i setti secondari appaiono formati da un sottile strato di tessuto connettivale fiancheggiato ai due lati da una doppia rete capillare (Fig. 14 c) e caratteriz-zato dalla pre- senza di elastina al suo apice. La presenza di ela-stina è un prere-quisito es sen-ziale per la for-mazione dei setti secondari, la cui strutturazione ha luogo solo dopo la deposizione di questa sostanza che sembra avere una funzione di sostegno dell’estroflessione dell’epitelio.


Figura 15. Differenziazione morfologica e funzionale dei pneumociti in cellule di tipo I e di tipo II durante la fase alveolare.
Anche la rete capillare va incontro ad un processo di ma- turazione, così da assumere gradualmente la morfologia tipica del bambino e dell’adulto. Già dalle prime settimane di vita postnatale si assiste ad un assottigliamento dell’interstizio dei setti alveolari con un progressivo avvicinamento delle due reti capillari, cui segue un processo di fusione. La trasformazione da doppio a singolo strato della rete capillare contenuta all’interno dei setti alveolari rappresenta l’ultimo stadio dello sviluppo polmonare (Fig. 14 d). Il progressivo assottigliamento dell’interstizio fa sì che strati epiteliali adiacenti vengano a contatto diretto, fino al formarsi di comunicazioni intralveolari o pori di Kohn, e spiega anche un altro fenomeno caratteristico delle prime fasi dello sviluppo postnatale del polmone, vale a dire il progressivo aumento della sua aerazione, definita dal rapporto tra contenuto d’aria e volume polmonare.
Oltre i 18-24 mesi lo sviluppo del polmone avviene parallelamente alla crescita della massa corporea e con un rapporto stabile tra contenuto aereo e volume polmonare.
La circolazione fetale
Circolazione fetale e neonatale
Molte sono le differenze fra la circolazione fetale, la circolazione di transizione alla nascita e la circolazione definitiva che assume le caratteristiche di circolazione “in serie” (Fig. 16).

Figura 16. La circolazione fetale.
Nel feto normale il sangue ossigenato proveniente dalla placenta percorre la vena ombelicale e si dirige in parte al fegato, in parte nella vena cava inferiore (VCI) attraverso il dotto venoso di Aranzio. Il sangue della VCI che arriva all’atrio dx contiene pertanto una elevata percentuale di ossigeno: nell’atrio dx avviene però pochissimo mescolamento tra il sangue più ricco di ossigeno proveniente dalla VCI e quello più denaturato della vena cava superiore (VCS). Una struttura particolare, la crista dividens, orienta il sangue prevalentemente arterioso verso l’atrio sinistro mentre quello venoso della VCS passa quasi totalmente in Vdx.
Il forame ovale quindi fa sì che nelle sezioni di sx circoli sangue più ricco di ossigeno: pertanto il fegato, il circolo coronario e la circolazione cerebrale sono territori privilegiati in quanto perfusi da sangue con quote più elevate di ossigeno. Il sangue meno ossigenato della VCS che passa prevalentemente nel V dx raggiunge l’arteria polmonare e da qui solo una piccolissima parte si dirige ai polmoni: quasi tutto il sangue passa in aorta discendente attraverso il dotto arterioso di Botallo; si mescola quindi al sangue più ossigenato dell’aorta ascendente e si dirige verso la parte inferiore del corpo. Dall’aorta discendente una quota di sangue, attraverso l’arteria ombelicale, raggiunge la placenta.
Le caratteristiche principali della circolazione fetale sono: l’assenza delle funzioni respiratorie polmonari, la presenza di distretti circolatori a basse resistenze (territorio placentare) ed alte resistenze (circolo polmonare). La peculiarità di questa circolazione è data dalla presenza e funzione di forame ovale, dotto arterioso, dotto venoso.
Modificazioni cardiocirolatorie alla nascita
Col taglio del cordone ombelicale e con i primi atti respiratori avvengono i cambiamenti fondamentali che portano alla separazione delle due circolazioni e la conseguente disposizione “in serie”.
L’inizio della funzione respiratoria provoca una brusca caduta delle resistenze e delle pressioni polmonari: quindi il sangue irrompe nelle arterie polmonari invece di dirigersi verso il dotto. Questo viene percorso per breve tempo in senso bidirezionale fino alla chiusura funzionale che avviene già nelle prime ore o nei primissimi giorni di vita.
Quando si verifica una normale riduzione delle resistenze vascolari polmonari, il sangue ossigenato arriva in atrio sx e, innalzando le pressioni in questa cavità, favorisce il collabimento della membrane del forame ovale e la sua successiva chiusura. L’interruzione del flusso ematico attraverso il cordone ombelicale provoca il collabimento delle pareti del dotto venoso con successiva trasformazione fibrosa; quest’ultimo evento è comunque di gran lunga meno importante, nel determinare l’assetto cardiocircolatorio definitivo rispetto alle modificazioni che riguardano le funzioni del dotto arterioso e del forame ovale. Il mantenimento di queste due strutture è però di grande importanza quando, in presenza di gravi malformazioni cardiache, è necessario avere una circolazione compatibile con la vita.
Persistenza della circolazione fetale
Si definisce con il termine di persistenza della circolazione fetale (PCF), denominata anche persistente ipertensione polmonare nel neonato, l’assenza o il ritardo delle fisiologiche modificazioni cardiocircolatorie alla nascita.
Normalmente, con l’espansione dei polmoni associata ad un aumento della PaO2, la pressione arteriosa polmonare cade rapidamente per la riduzione del tono vascolare. La diminuzione della pressione nel piccolo circolo e l’aumento della pressione sistemica contribuiscono al passaggio verso la circolazione in serie, di tipo adulto.
La tensione di ossigeno a livello della tunica muscolare costituisce uno degli stimoli più efficaci nella trasformazione delle arteriole dal tipo fetale, più spesse e meno distensibili, al tipo adulto. Occasionalmente le resistenze vascolari nel piccolo circolo rimangono alte anche dopo la nascita con conseguente ipertensione polmonare; quindi lo shunt dx-sx a livello del dotto arterioso e del forame ovale persiste per un periodo più lungo. Questa situazione innesca un circolo vizioso perchè l’ipossia aumenta ulteriormente le resistenze polmonari. La cianosi molto intensa è il sintomo principale di questa sindrome, in neonati a termine e postmaturi.
Si distinguono una forma primitiva, con alterazione anatomica del circolo arterioso polmonare e forme secondarie. Inoltre la PCF può essere associata a numerose situazioni patologiche: l’ernia diaframmatica congenita, l’ipoplasia polmonare primitiva, la postmaturanza, l’asfissia grave, l’aspirazione da meconio.
Comunque, la condizione comune è l’ipossia con conseguente pressione polmonare soprasistemica e shunt dx-sx.
Differenze anatomo funzionali del sistema respiratorio tra il neonato a terimine, il pretermine e l’individuo adulto

Figura 17. Configurazione della gabbia toracica nell’adulto (in alto a destra) confrontata con quella di un lattante (in alto a sinistra). Accrescimento delle coste a livello costo condrale e agli angoli posteriori delle coste, come possibile spiegazione delle modificazioni nella forma del torace vista in sezione (in basso a sinistra e a destra.
La conoscenza dei meccanismi fisiologici respiratori dell’individuo sano è, come già sottolineato, utile per comprendere e gestire gli aspetti respiratori nel bambino con grosse difficoltà anatomiche, fisiologiche e funzionali. Qui di seguito sono riportate le differenze anatomo-funzionali tra adulto e bambino, utili per cercare di valutare le caratteristiche funzionali del neonato a termine e del pretermine.
In relazione all'età il bambino, presenta una serie di differenze anatomiche, funzionali e comportamentali che devono essere tenute in considerazione al fine di comprendere ciò che si osserva e per far sì che l'analisi dei dati soggettivi e oggettivi sia adeguata e utile per programmare un intervento fisioterapico.
L'anatomia del tratto respiratorio superiore è simile nel neonato a quella dei primati, in modo particolare per la localizzazione della laringe, che è posta più in alto: l'epiglottide è quasi a contatto con il palato molle e il tragitto dell'aria e del cibo non s'incrociano. Ciò permette al bambino di poter respirare e alimentarsi allo stesso momento fino a circa 3-4 mesi di età (Laitman, 1986). Ciò ha portato alla conclusione che i bambini respirano nei primi mesi obbligatoriamente dal naso e che qualsiasi ostruzione nasale porta ad apnea. È osservabile clinicamente che, se il naso è ostruito da secrezioni e/o da tubi, questi aumentano il lavoro della respirazione (che può essere osservato clinicamente con un aumento dei segni di distress respiratorio e cioè, ad esempio, uso dei muscoli accessori, rientramenti giugulari, intercostali e diaframmatici) e gli episodi di apnea. In caso di occlusione nasale, la diminuzione della Sa02 e la pressione negativa endonasale attivano la respirazione orale (Moretti, 2002).
Alla nascita, la struttura delle vie aeree è ultimata e non avvengono più grandi cambiamenti nel numero delle generazioni delle stesse. Il supporto cartilagineo sostiene le vie aeree di conduzione fino ai bronchi segmentari. È presente fin dalla nascita, ma aumenta il suo ruolo di sostegno alle vie aeree fino alla fine dell'infanzia.

Figura 18. La gabbia toracica
In caso di patologia è possibile che si verifichi un aumento più consistente delle resistenze rispetto all'adulto. Ad alte velocità dei flussi espiratori si può più facilmente verificare un collasso della trachea.
Nel lattante, e ancor più se nato pretermine, il diametro delle vie aeree è più piccolo e offre un'alta resistenza al flusso aereo, soprattutto nelle condizioni patologiche. L’edema delle vie aeree, in caso d'infiammazione, è più importante: la presenza di un millimetro di edema nella circonferenza di un bronco di un bambino riduce la sezione fino al 75% rispetto al 25% di quello di un adulto (Prasad, 1995). Entrambi i fattori appena descritti possono aumentare in modo importante il lavoro della respirazione.
La struttura delle pareti bronchiali nei bambini è differente: la cartilagine è più cedevole e vi sono, in proporzione, più ghiandole mucose. Entrambi questi fattori predispongono all'ostruzione delle vie aeree e al loro collasso.

Figura 19. Il diaframma del neonato (a) ha una conformazione più piana rispetto a quello dell’adulto (b); la ridotta escursione ne limita le possibilità di compenso.
Il numero degli alveoli, da 150 milioni diventeranno 300-400 milioni, e il loro diametro, da 180 μm diventerà 300 μm. La maggior parte degli alveoli si sviluppa durante il primo anno di vita e, fino a 3 anni, la crescita polmonare è dovuta alla moltiplicazione alveolare. Il piccolo diametro degli alveoli può facilitare il loro collasso. Dai 3 ai 7 anni gli alveoli crescono in numero e dimensioni. Dall'età di 8 anni gli alveoli crescono solo in dimensioni fino a quando la gabbia toracica smette di crescere. La ventilazione collaterale, anche se presente, è poco sviluppata fino ai 2-3 anni di età e ciò predispone al collasso alveolare.
Per quanto riguarda il sistema osteoarticolare, le coste sono più orizzontali, la forma della gabbia toracica è più circolare con conseguente minore possibilità d'escursione in-espiratoria (Fig. 19). La gabbia toracica ha un'alta compliance che si traduce in una bassa pressione transpolmona-re a fine espirazione, con tendenza alla chiusura precoce delle piccole vie aeree anche durante il respiro a volume corrente. Con la crescita, la gabbia toracica diventa più rigida e può offrire un maggiore sostegno ai polmoni, contribuendo maggiormente al volume corrente e riducendo i movimenti asincroni o paradossi.
Inoltre, sempre con la crescita, il contenuto addominale scende e si crea così una maggiore pressione intrapleurica negativa alle basi.
La configurazione della gabbia toracica del neonato tende ad essere circolare in sezione orizzontale, a differenza dell’adulto, in cui invece appare di forma ellissoidale.
La posizione piuttosto orizzontale delle coste, favorisce la stabilità del torace del neonato insieme ai muscoli intercostali che, contraendosi simultaneamente al diaframma, hanno la funzione di fornire rigidità alla gabbia toracica, piuttosto che ad espanderla durante la fase inspiratoria.
L’angolo di inserzione del diaframma nel bambino è all’incirca orizzontale e questo rende ragione della minore efficienza contrattile. La contrazione del diaframma tende a muovere la gabbia toracica verso il basso; in questo modo il diaframma tende ad avere una minor escursione verso il basso, con conseguente aumento della pressione intra-addominale e minor espansione della gabbia toracica.

Figura 20. Rappresentazione schematica degli effetti della distorsione della gabbia toracica sul volume di gas spostato dal diaframma durante la fase inspiratoria: per compensare la distorsione del torace e mantenere costante il volume corrente il diaframma deve compiere una maggiore escursione e quindi un maggiore lavoro.
Il torace del prematuro è facilmente soggetto a distorsione per la scarsa ossificazione delle coste e dello sterno e per la ridotta funzionalità dei muscoli intercostali; la compliance della gabbia toracica è particolarmente elevata, mentre quella del polmone è leggermente inferiore a quella dell’adulto. Durante l’inspirazione, la distorsione del torace carica il diaframma di un ulteriore lavoro: per mantenere costante il volume corrente, l’escursione del diaframma deve infatti aumentare in modo da compensare il movimento paradosso della gabbia toracica; questo fenomeno contribuisce ad accelerare l’esaurimento funzionale respiratorio cui vanno incontro i bambini di basso peso.

Figura 21. La presenza della CFR fa sì che ad ogni atto respiratorio solo una piccola parte dell’ara alveolare venga rinnovata; in tal modo le concentrazioni dei gas all’interno dell’alveolo rimangono relativamente stabili.
La cedevolezza della gabbia toracica provoca una maggior tendenza alla distorsione quando la pressione pleurica diventa molto negativa e quando l’azione stabilizzante dei muscoli intercostali è inibita.
La parete toracica del neonato è più compliante e contribuisce poco a determinare la capacità funzionale residua (CFR) statica: questo fenomeno tende a posizionare il livello della CFR vicino al volume residuo e induce una chiusura precoce delle vie aeree (Figura 21). In un neonato a termine il surfattante è la principale forza per evitare il collasso alveolare (nel pretermine il surfattante è insufficiente). Il bambino, inoltre, mette in atto dei compensi fisiologici, ossia una ventilazione con tempi brevi e un'attività diaframmatica post-inspiratoria, frenando con la glottide nel tentativo di mantenere valori adeguati della CFR. La CFR nel neonato è pertanto determinata più dinamicamente che staticamente. La transizione verso un'espirazione più rilassata si verifica tra i 6 e i 12 mesi di età. In rapporto ai volumi e alle capacità polmonari, il bambino presenta un volume di chiusura di valore più grande che, in posizione supina, diventa maggiore della CFR (una gabbia cedevole come quella del bambino piccolo contribuisce poco a mantenere un adeguato volume di riposo), e ciò predispone alla formazione di atelettasie anche durante il respiro a normale volume corrente. Il volume polmonare a riposo del bambino è il 10-15% rispetto alla capacità polmonare totale, mentre nell'adulto il valore è di circa il 30%. La CFR è ridotta e si riduce ancora di più nelle seguenti condizioni: posizione supina, distensione addominale, raccolta di liquido o d'aria intratoracica, edema, sindrome del distress respiratorio.

Figura 22. Diagrammi pressione/vo lu- me in un neonato con RDS (linea tratteggiata e di un neonato normale (linea continua).
In relazione con l'età gestazionale ci sono una massa muscolare ridotta e una bassa percentuale di fibre di tipo I. Le fibre muscolari di tipo I sono rappresentate nella misura del 10% in un pretermine e del 25% in un neonato a termine normale. La capacità ossidativa cresce a partire da metà dell'età gestazionale fino alla prima infanzia.
Sempre in relazione alla età gestazionale, il bambino presenta un'alta percentuale di sonno REM3. Durante il sonno REM, i muscoli intercostali, che normalmente svolgono la loro azione per fissare la gabbia toracica, sono inibiti e, a causa della cedevolezza della gabbia toracica, si possono evidenziare maggiormente distorsioni e rientramenti; inoltre, durante il sonno REM il diaframma lavora significativamente di più e la CFR diminuisce. Se un bambino nasce prima del termine, il sonno REM ha un'influenza ancora più importante, considerando che il tempo totale del sonno può arrivare fino a 20 ore al giorno, delle quali l'80% è sonno REM rispetto a una quota del 40% di un bambino di 3 mesi.
I neonati, soprattutto pretermine, hanno uno schema respiratorio irregolare, che può portare ad apnee. Sebbene brevi periodi d'apnea siano considerati normali, apnee di lunga durata o quelle che richiedono una stimolazione per ottenere il riavvio della respirazione andrebbero indagate.
I bambini hanno un metabolismo basale che produce un maggior consumo d'ossigeno rispetto all'adulto. Ogni aumento della domanda energetica può più facilmente produrre ipossia. L'ipossia nei lattanti può causare bradicardia (meno di 100 battiti/minuto) piuttosto che tachicardia, come nell'adulto. La fase espiratoria, al contrario, è solitamente un fenomeno passivo determinato dalla forze di retrazione elastica dei tessuti distesi; maggiore è la forza di distensione del polmone durante l’inspirazione, maggiore è la tendenza al ritorno elastico. L’intervento dei muscoli respiratori si verifica solo in alcune situazioni quali la tosse e lo starnuto.
Gli scambi respiratori sono quindi assicurati soprattutto dall’attività del diaframma, meno efficiente nel neonato rispetto all’adulto per una conformazione più piana che ne riduce l’escursione e per le sue caratteristiche istologiche.
Nel pretermine infatti la percentuale delle fibre diaframmatiche a contrazione lenta e resistenti all’ossidazione e alla fatica (fibre di tipo I), costituisce solo il 10% del totale (mentre nell’adulto rappresenta il 50-60%) rispetto alle fibre a contrazione rapida ma a veloce esaurimento (fibre tipo II). Il rapporto tra la presenza di fibre I e la fatica muscolare è inversamente proporzionale; la scarsità di fibre di tipo I rende il bambino poco adeguato a sostenere alti carichi di lavoro respiratorio a causa della ridotta capacità ossidativi.
La percentuale delle fibre tipo I aumenta progressivamente con l’età.
Altri fattori che sembrano correlati alla precoce affaticabilità muscolare, sono costituiti dall’elevata frequenza respiratoria e dall’insufficiente apporto calorico-proteico.
Il grado di maturazione del circolo polmonare infine, condiziona il quadro clinico delle patologie cardiorespiratorie dell’età neonatale, che presentano un’alterazione del rapporto ventilazione/perfusione determinata dalla scarsa capacità di mantenere elevate le resistenze polmonari.
In sintesi, il bambino, rispetto all'adulto, e ancor di più se nato pretermine, presenta tutta una serie di differenze (Tabella 5) che fanno sì che i meccanismi di difesa nei confronti dell'ostruzione siano meno efficaci rispetto all'adulto.
|
DIFFERENZE ANATOMICHE E FUNZIONALI DEL BAMBINO RISPETTO ALL'ADULTO. |
||
|
|
Cosa |
Differenze rispetto all'adulto |
|
Resistenza vie aeree superiori |
Maggiore |
|
|
Numero alveoli |
|
Minore |
|
Diametro alveolare |
Minore |
|
|
Diametro vie aeree |
Minore |
|
|
Stabilità vie aeree |
Minore |
|
|
Surfattante |
|
Minore nel pretermine |
|
Ventilazione collaterale |
Ridotta |
|
|
Coste |
|
Orientamento più orizzontale |
|
Compliance della gabbia toracica |
Maggiore (con scarso supporto a fine espirazione) |
|
|
Compliance polmonare specifica |
Minore nel pretermine |
|
|
Tono muscolare |
Maggiore dipendenza dalla fase REM |
|
|
Tipo fibre muscolari |
In % differente |
|
|
Orientamento del diaframma |
Più appiattito |
|
|
Resistenza del diaframma |
Maggiore facilità all'affaticamento |
|
|
FRC |
|
Minore |
|
TLC |
|
Minore |
|
Capacità di chiusura |
Maggiore |
|
|
Volume corrente |
Più vicino al volume di chiusura |
|
|
Pattern respiratorio |
Respirazione prevalentemente "diaframmatica" |
|
|
Compensi |
|
Maggiore frequenza rispetto a maggiore profondità |
|
Cuore, timo |
|
Relativamente più grandi (meno spazio per il tessuto polmonare) |
|
Tosse |
|
Debole o assente nel pretermine |
Tabella 5
Da quanto esposto da Oberwaldner (2000) si rileva che il bambino è più a rischio di presentare una chiusura delle vie aeree, dispone di minor volume polmonare e presenta una gabbia toracica con alta compliance: questi tre fattori vanno tenuti presenti anche per eventuali manovre fisioterapiche.
In conclusione, riassumendo, la nascita pretermine influisce in modo determinante sul delicato sviluppo del polmone che così presenta le seguenti caratteristiche:
- Scarsa crescita delle strutture alveolari, dovuta all’incompleto sviluppo delle vie aeree terminali;
- La barriera alveolo-capillare presenta uno spessore nella norma, in quanto aumentato sia a livello dell’epitelio degli alveoli primitivi (o sacculi), sia a livello dell’interstizio che li separa dal letto capillare;
- Ridotta funzione di surfattante, il quale risulta indispensabile a ridurre le forze di tensione superficiale che tendono a far collabire alveoli e bronchioli respiratori, in misura inversamente proporzionale alla dimensione del loro raggio. Anche il ruolo della difesa antibatterica che il surfattante riveste viene a mancare;
- Mancato riassorbimento del liquido polmonare.
Considerazioni sull’azione dei muscoli respiratori
Il diaframma rappresenta senza dubbio il principale muscolo della respirazione.
La massima tensione muscolare che il diaframma è in grado di sviluppare si ottiene alla lunghezza a riposo, cioè quando il muscolo presenta la curvatura fisiologica prima della inspirazione e, per l’esattezza, corrisponde ad un volume polmonare di poco inferiore a quello della capacità residua funzionale.
Al progressivo aumento del volume polmonare le fibre del diaframma, come pure quelle degli altri muscoli inspiratori si accorciano e, di conseguenza, la forza che sono in grado di sviluppare diminuisce.
Secondo la relazione di Laplace (Pressione = Tensione x 2 / Raggio), esisterebbe un rapporto di proporzionalità inversa tra la misura del raggio e la massima pressione generabile dal diaframma, a parità di tensione. L’aumento del volume polmonare comporta un aumento del raggio di curvatura del diaframma; un diaframma più appiattito genera una pressione inferiore e quindi richiede un lavoro maggiore per la respirazione.
I muscoli intercostali agiscono fissando la gabbia toracica.
Durante il sonno REM, quando cioè gli intercostali risultano inibiti, la gabbia toracica presenta una cedevolezza più accentuata e quindi contribuisce in scarsa misura al mantenimento del volume corrente.
I muscoli accessori, soprattutto sternocleidomastoideo e scaleni, attivati in modo sincrono, garantiscono alla gabbia toracica un movimento con un solo grado di libertà funzionale, consentendo l’elevazione di quest’ultima durante l’inspirazione, soprattutto quando la contrazione isolata del diaframma e degli intercostali non è sufficiente.
La contrazione dei muscoli della parete addominale è importante nel determinare la posizione del diaframma, attraverso la modificazione della pressione intra-addominale e l’abbassamento delle ultime coste; contribuisce altresì all’ispirazione ostacolando un’eccessiva discesa della cupola diaframmatica.
3 Rapid eye movement, indicato più di frequente con l'acronimo REM, è il "movimento rapido degli occhi" (nistagmo) che avviene durante una fase del sonno, accompagnato da altre alterazioni corporali fisiologiche come irregolarità cardiaca, respiratoria e variazioni della pressione arteriosa.
| Indice |
| ABSTRACT e INTRODUZIONE |
| CONCLUSIONI |
| BIBLIOGRAFIA |
| Tesi di Laurea di: Lucia CAMISASSA |